疎水性相互作用と電荷移動錯体
疎水性相互作用
水溶液中に油などの疎水分子が存在すると、疎水分子が水を避けて集まろうとします。
あたかも疎水分子間に引力が働いているように見えます。
青い丸・・・水分子
オレンジ・・・疎水分子
このように疎水分子が集まる(会合)することにより疎水分子の周りの水分子が構成していた三次元的な水分子間の構造が破壊され、エントロピーが増大します。
このような現象は生体内ではタンパク質の工事構造の安定化(疎水基を多く持つアミノ酸は内側をむくことで構造が安定する。)や薬物と血漿蛋白との結合に関与します。
身近な例ですと、洗剤があります。
洗剤の中の界面活性剤は炭化水素基からなる疎水基と親水基が結合した構造を持っています。
その界面活性剤を水溶液中に入れると疎水基は水分子を避けるように内側に、親水基は外側に向けて会合してミセルを形成します。
詳しくはこちらを参照してください。
どうして汚れはおちるの?ケミカル・ワンダータウン
電荷移動錯体
電子供与体Dから電子受容体Aへ部分的な電子の移動により系を安定化する結合です。
電子の移動が完全に行われる⇆電子が移動しない
間に共鳴が起こり安定化します。
このとき新しい軌道(吸収帯)が紫外領域に現れることが特徴です。
例)電子供与体D ー 電子受容体A
アミン ー ヨウ素錯体
アミン類 ー 金属イオン
化学結合と分子間相互作用
化学結合・分子間相互作用のまとめ
|
|
|
ポテンシャルエネルギー |
力 |
||
|
非常に強い |
- |
- |
|||
|
イオン結合(クーロン力)
|
非常に強い |
rに反比例 比較的長距離 |
r2に反比例 (クーロン力) |
||
|
分子間相互作用 |
水素結合 |
強い |
- |
- |
|
|
ファンデルワIルス力 |
永久双極子ー双極子 |
比較的強い |
r3に反比例 近距離 |
- |
|
|
永久双極子ー誘起双極子 |
比較的弱い |
r6に反比例 ごく至近距離 |
- |
||
|
瞬間双極子ー誘起双極子 (ロンドン分散力) |
非常に弱い |
r6に反比例 ごく至近距離 |
- |
||
化学結合
原子は原子核と電子から構成されています。さらに、原子核は陽子と中性子
から構成されています。
原子の状態によって、イオン結合、共有結合、金属結合に分類されます。
|
イオン結合 |
|
|
原子間での共有電子対と原子核間の引力 |
|
|
自由電子と金属原子の静電的引力 |
イオン結合と共有結合の違い
共有結合とイオン結合の間には本質的な違いは何もありません。
では、どうやってその二つを分けているのでしょうか。
共有された電子の偏り具合で決めるのです。
異種原子間の結合では、二つの原子が同じじゃありませんからどちらかの原子にある程度電子が偏って分布します。
このときの偏りが50%に達しなければ共有結合、50%を超えればイオン結合と言います。
具体的には電気陰性度の差が1.7以上あればイオン結合と言えます。
金属結合は共有結合の派生⁉︎
金属元素は最外殻電子を放出して陽イオンになりやすく、放出された電子は自由電子
として複数の金属原子間を動き回ることができます。
金属原子の核電荷と自由電子の負電荷の間に生じる静電的引力により金属結合が形成されます。
xn--qck0d2a9as2853cudbqy0lc6cfz4a0e7e.xyz
化学結合には他にも配位結合というものがありますね。
配位結合
配位結合とはある原子の電子対が他の原子に提供されて両者で電子対を
共有する結合です。
錯体は中心金属に配位子が配位することでできます。
*たまに聞かれる結晶場理論って何?
https://blog.hatena.ne.jp/aribabi/aribabi.hatenablog.com/edit?entry=17391345971620559373
分子間相互作用
ファンデルワールス力とは分子間相互作用の中で中性分子・原子間に働く斥力・引力の総称であり、ポテンシャルエネルギーが分子間距離の6乗に反比例するものをいいます。
ほとんどの物質間で作用して、コロイド粒子間や粉体粒子間にも見られます。
双極子の種類
①永久双極子
結合に関与する原子間の電気陰性度の差による双極子です。
電気陰性度が異なる原子同士が結合していると、わずかに電荷に偏りが生じます。
N-H結合ではNの方が電気陰性度が高いのでNが少しマイナスの電荷を帯び(δー)、Hが少しプラスの電荷(δ+)を帯びることになります。
電気陰性度が強いということは電子を引き付ける力が強いということです。電子はマイナスの電荷を帯びているので、電気陰性度が強い窒素原子の方がマイナスの電荷を帯びるということが理解できます。
このように正電荷と負電荷の偏りが非常に近くで存在している状態を分極といい、分極している分子を双極子といいます。
②誘起双極子
無極性分子が周囲の双極子や電荷の偏りを誘起させる環境によって双極子となること
をいいます。
③瞬間双極子
電子は常に動き続けています(電子雲の揺らぎ)。分子内で常に動き続けている電子は瞬間的にδーとδ+の部分が生まれます。これにより電荷の偏りが生まれて双極子が生まれます。
双極子間の相互作用
①永久双極子と永久双極子
配向力(Keesom力)永久双極子のδー部分ともう一つの永久双極子のδ+が引き合う相互作用をいいます。
②永久双極子と誘起双極子
誘起力(Debye力)無極性分子が双極子により、誘起双極子となり永久双極子と相互作用します。
③瞬間双極子と誘起双極子
分散力 電子雲の揺らぎによりできた瞬間双極子により他の無極性分子を誘起してできた誘起双極子との相互作用です。この引力はファンデルワールス力のほとんどを占めます。

水素結合
電気陰性度が大きな原子に共有結合で結びついた水素原子が近くの、窒素、酸素などの電気陰性度の大きい原子と孤立電子対とつくる非共有結合性のことです。
こんな感じの結合です。
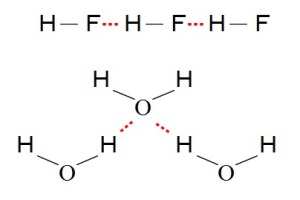
水素結合の強さによる融点の上昇
・電気陰性度が大きいほど、水素結合は大きくなります。
・分子間 >分子内

因みに電気陰性度の大きさってどう見分けるの?
って思う人もいると思います。
実際、薬学では F > O > N > Cl を覚えておけばいけます。
フォンクル とか適当に覚えておくと忘れません笑。
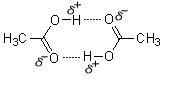
酢酸をご覧ください。酢酸は分子間で2つ水素結合を形成します。
この知識を使って解く問題もあるので覚えておいてください。
疎水性相互作用と電荷移動錯体
https://blog.hatena.ne.jp/aribabi/aribabi.hatenablog.com/edit?entry=17391345971620555936
